|
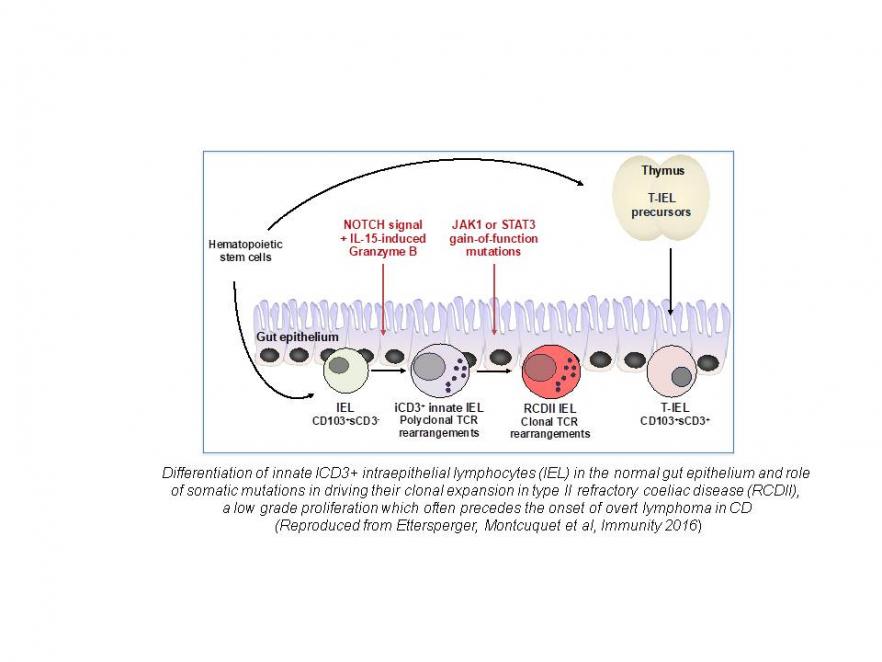
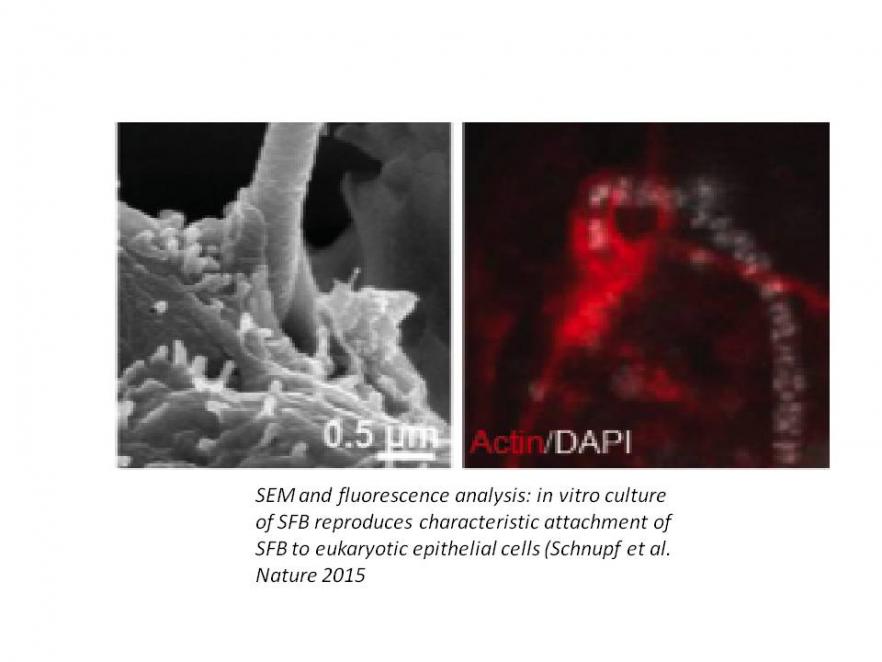
La maladie cœliaque (MC) est un axe de recherche de longue date de notre équipe. Cette maladie fréquente apparentée aux maladies auto-immunes est induite par le gluten alimentaire chez les individus prédisposés génétiquement. La MC est généralement guérie par un régime strict sans gluten et il est maintenant bien établi que les molécules HLA-DQ2 ou -DQ8, qui sont le principal facteur de prédisposition génétique, peuvent orchestrer l'activation de lymphocytes T CD4 + spécifiques du gluten. Néanmoins, des complications graves sont possibles, notamment des maladies auto-immunes extra-digestives et des lymphomes intestinaux. La MC est ainsi une maladie modèle pour analyser les mécanismes qui préviennent autoimmunité et réponses immunes adverses aux protéines alimentaires chez l'homme, mais aussi pour étudier les liens entre inflammation chronique et lymphomagenèse. En nous appuyant sur l'analyse d'une large cohorte de patients, sur l’étude in situ et ex vivo de lymphocytes intestinaux humains et sur des modèles murins, nous étudions les mécanismes des lésions intestinales et des lymphomes. Nous avons montré que l'interleukine 15 (IL-15) est un acteur clé. Cette cytokine altère les mécanismes immunorégulateurs et coopère avec les cellules T CD4 + spécifiques du gluten pour activer les lymphocytes T CD8 + cytotoxiques et les lésions tissulaires. L'IL-15 favorise également l'apparition de lymphomes à partir d’une population particulière de lymphocytes innés qui partagent des caractéristiques T et NK sont présents dans l'épithélium intestinal. Nous avons précisé les étapes qui conduisent à la différenciation de ces lymphocytes en réponse à une combinaison de signaux NOTCH et IL-15. Nous avons également montré que leur transformation maligne est liée à l'acquisition de mutations somatiques gain de fonction dans JAK1 et STAT3. Ces mutations confèrent un avantage sélectif dans l'environnement riche en cytokines (IL-15-) de l'intestin cœliaque et permettent leur expansion clonale au détriment des lymphocytes T résidents normaux. Notre travail actuel s’appuie sur des approches génomiques et des analyses sur cellules uniques pour préciser les mécanismes qui conduisent à la transformation et à la progression maligne et vise à utiliser ces résultats pour améliorer les stratégies diagnostiques et thérapeutiques. Cet axe de recherche plus récent a été lancé en 2014 grâce à une subvention « Advanced ERC » avec deux objectifs complémentaires : 1- s’appuyer sur l’étude des maladies monogéniques pour identifier les mécanismes indispensables au maintien de la barrière intestinale humaine; 2- mettre en place une plateforme de diagnostic et améliorer la prise en charge de maladies rares mais très sévères qui débutent le plus souvent très tôt dans la vie. Les patients sont étudiés en collaboration avec les cliniciens français (protocole Immunobiota) ou européens (réseau GENIUS). Le défaut moléculaire est recherché en combinant analyses génomiques et fonctionnelles. Une cause génétique précise a été identifiée chez 32% des 450 patients déjà étudiés. L’identification du défaut génétique a permis d’optimiser le traitement . Chez une patiente résistante à tous les traitements immunosuppresseurs, une rémission durable a pu être obtenue en ciblant la mutation gain de function identifiée dans STAT3 par un inhibiteur de JAK1. De nouvelles mutations dans le récepteur de l'IL-10 à l’origine d’une colite d'apparition très précoce ont été identifiées, dont une avec un effet fondateur ainsi que des mutations dans MALT1 responsables d'une entéropathie auto-immune associée à un déficit immunitaire sévère ère. Des mutations bialléliques affectant des gènes épithéliaux tels DUOX2, une NADPH oxydase épithéliale qui permet la production de radicaux oxygénés bactéricides et dans la phosphatase alcaline intestinale qui permet d’atténuer les effets proinflammatoires du LPS bactérien ont été identifiées comme de nouvelles causes génétiques de colites précoces. Plusieurs nouveaux gènes candidats sont à l'étude qui affectent la différenciation des cellules épithéliales et ou la régulation du système immunitaire. Parallèlement à ces travaux, un programme H2020 coordonné par F. Ruemmele vise à évaluer et à améliorer le traitement des maladies inflammatoires intestinales pédiatriques. Dialogue hôte-microbiote et développement de la barrière intestinale Le microbiote intestinal est désormais considéré un déterminant clé en santé et en pathologie. Un défi important est d’identifier les bactéries capables favoriser la santé de leur l'hôte, de comprendre leur mécanisme(s) d’action et les conditions qui contrôlent leur croissance dans l’intestin. Grâce à l’étude de souris gnotobiotiques, nous avons démontré que les bactéries filamenteuses segmentées (SFB) sont indispensables pour induire la maturation post-natale de la barrière immunitaire intestinale. Les SFB sont notamment un puissant inducteur du tissu lymphoïde intestinal secondaire et tertiaire. Elles stimulent fortement la sécrétion d'IgA et les cellules T intestinales et sont indispensables pour stimuler les réponses TH17 intestinales homéostatiques. Les SFB jouent aussi un rôle déterminant dans l’effet barrière du microbiote contre les enteropathogènes. Contrairement aux autres bactéries commensales, qui résident généralement dans la lumière intestinale et ont un accès limité à la surface intestinale, les SFB se fixent aux cellules épithéliales iléales. Cet attachement est spécifique de chaque espèce hôte, suggérant une coévolution entre les SFB et leurs hôtes vertébrés. Une méthode de culture in vitro de SFB a été développée en s’appuyant sur l'hypothèse que les cellules épithéliales fournissent à ces bactéries les ressources indispensables à leur croissance. Nos objectifs actuels sont d'identifier les mécanismes qui contrôlent la colonisation de l’intestin par SFB et la stimulation de la réponse immune mais aussi de caractériser SFB dans le microbiote humain. Ce travail se poursuit en collaboration avec P. Schnupf, microbiologiste, qui a récemment fondé son propre groupe de recherche à l'Institut INEM et souhaite à terme transformer SFB en une plateforme vaccinale. |